Gadolínio
[ad_1]

O gadolínio é um elemento químico do grupo dos lantóides ou terras raras.
Visão geral: dados gerais sobre gadolínio
O átomo de gadolínio
A característica de identificação do átomo de Gd – e, portanto, do elemento gadolínio – é o número de prótons no núcleo atômico (número atômico ou número de prótons) e – no estado descarregado – o mesmo número de elétrons na camada atômica; isto é 64 em cada caso e determina o número atômico, número atômico ou número atômico do gadolínio.
Os blocos de construção nuclear dos nêutrons garantem diferenças nos núcleos atômicos de Gd com o mesmo número atômico. Esses tipos de átomos estão sob o termo Isótopos de gadolínio ou nuclídeos (dados de isótopos: veja lá).
Os depósitos de gadolínio terrestre consistem em uma mistura de isótopos; a massa atômica relativa é, portanto, dada como 157,25 (3) u.
Configuração de elétron
| símbolo | OZ | forma curta | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 6s | 6p | 6d | 6f |
| D’us | 64 | [Xe] 4f7º 5d1 6s2 | 2 | 2 | 6º | 2 | 6º | 10 | 2 | 6º | 10 | 2 | 6º | 1 | 2 |
Energias de ionização
A tabela a seguir lista as energias de ligação ou as energias de ionização IE de gadolínio, ou seja, a energia necessária em elétron-volts (eV) para separar um elétron específico de um átomo de Gd.
| 1. IE: | 6,14980 eV | 2. IE: | 12,09 eV | 3. IE: | 20,63 eV | 4. IE: | 44,0 eV | 5. IE: | eV | 6. IE: | eV |
Energia de ligação de elétrons
A tabela a seguir lista as energias de ligação de elétrons dos elétrons de gadolínio individuais nos respectivos orbitais. Os valores são dados em elétron-volts (eV).
| K | LI | LII | LIII |
| 1s | 2s | 2p1/2 | 2p3/2 |
| 50239 | 8376 | 7930 | 7243 |
| MI | MII | MIII | MIV | MV |
| 3s | 3p1/2 | 3p3/2 | 3d3/2 | 3d5/2 |
| 1881 | 1688 | 1544 | 1221,9 | 1189,6 |
| NI | NII | NIII | NIV | NV | NVI | NVII |
| 4s | 4p1/2 | 4p3/2 | 4d3/2 | 4d5/2 | 4f5/2 | 4f7/2 |
| 378,6 | 286 | 271 | – | 142,6 | 8,6 | 8,6 |
| OI | OII | OIII | OIV | OV |
| 5s | 5p1/2 | 5p3/2 | 5d3/2 | 5d5/2 |
| 36 | 28 | 21º |
Dados adicionais
180 pm (empírico, de acordo com Slater)
169 pm (em ligações simples, após Pyykkö et al.)
135 pm (em ligações duplas, após Pyykkö et al.)
132 pm (em ligações triplas, de acordo com Pyykkö et al.)
Linhas espectrais do gadolínio
A figura a seguir mostra um espectro de emissão de gadolínio com as linhas espectrais características na faixa de comprimento de onda visível entre 400 e 700 nm:

Química do Gadolínio
Gadolínio está na grande maioria de seus compostos no estado de oxidação + III e prontamente compartilha seus elétrons de valência com a maioria dos outros elementos para formar compostos de gadolínio (III). Estruturas binárias são criadas em temperaturas elevadas com nitrogênio, carbono, enxofre, fósforo, boro, selênio, silício e arsênio.
Os compostos de gadolínio reduzidos são particularmente conhecidos no estado sólido. Por exemplo, halogenetos de gadolínio (II) podem ser preparados em recipientes de tântalo por aquecimento de halogenetos de Gd (III) na presença de Gd metálico.
O gadolínio também forma sesquicloreto de fórmula Gd2Cl3, que pode ser posteriormente reduzido a cloreto de gadolínio (I) (GdCl) por têmpera a 800 ° C; isso forma plaquetas com uma estrutura semelhante a grafite em camadas.
Em contraste com os outros elementos de terras raras, o gadolínio metálico é relativamente estável no ar seco. No ar úmido, no entanto, rapidamente escurece e forma uma camada fracamente aderente de óxido de gadolínio (III) (Gd2O3), que – semelhante à ferrugem – descama e expõe ainda mais o gadolínio à oxidação.
O gadolínio é um poderoso agente redutor, que reduz os óxidos de vários elementos e assim libera os metais. Além disso, é eletropositivo e reage lentamente com água fria e muito mais rápido com água quente para formar hidróxido de gadolínio (Gd (OH)3) e hidrogênio elementar.
Dados químicos
Propriedades materiais e físicas do gadolínio
A visão geral a seguir lista alguns dados físicos e propriedades do material do gadolínio puro.
0,236 J g-1 K-1 (específico)
7,4 g cm-3 (líquido, no ponto de fusão)
397,5 kJ mol-1 (gasoso)
194,3 J mol-1 K-1 (gasoso)
Perigos e segurança

perigo
(Informações gerais sem garantia de exatidão e integridade)
Pó de gadolínio:
H228 – Sólido inflamável.
H260 – Em contato com a água libera gases inflamáveis que podem se inflamar espontaneamente.
Ofertas de informação externa
Itens do grupo – informação
Separação de lantanóide 1
Extração e separação de lantanóides. FH Münster – Formato: PDF
Separação de lantanóide 2
Extração e separação de lantanóides. FH Münster – Formato: PDF
Lantanóides
Materiais de aula: química dos metais. Universidade de Friburgo
Lantanóides
Geral, separação, extração, propriedades, orbitais 4f etc. Universidade de Bielefeld
Conexões individuais
Compostos de gadolínio e gadolínio
Base de dados química: propriedades físicas e químicas, fichas de dados de segurança, substâncias e compostos disponíveis no mercado; vários critérios de pesquisa, incluindo pesquisa de estrutura
Análise e determinação
Agentes de contraste à base de gadolínio em amostras biológicas
Investigações sobre a captação e distribuição de meios de contraste à base de gadolínio em amostras biológicas por meio de ablação a laser com espectrometria de massa com plasma indutivamente acoplado. Dissertation Chemistry, HU Berlin, (2016) – Formato: PDF
Geoquímica e biogeoquímica
Minerais contendo gadolínio
Informações sobre o gadolínio e os minerais de gadolínio. Atlas de Minerais
Geoquímica de terras raras
Notas de aula abrangentes. Universidade de Colônia – Formato: PDF
migração
Investigações sobre a migração de európio e gadolínio em caulinita como mineral modelo para um repositório. Dissertação, 2007. Saarland University
Terra rara
Perfil econômico da matéria-prima. BGR
Metais de terra rara
Extração, uso e reciclagem – Formato: PDF
Minerais de terras raras
Lista e composição percentual das terras raras individuais que ocorrem na natureza
Química ambiental
Meios de contraste contendo gadolínio
Comportamento ambiental e ecotoxicologia de meios de contraste para ressonância magnética contendo gadolínio. Dissertação, 2008. TU Berlin
Toxicologia, medicina, fisiologia
Ligante baseado em AAZTA
Síntese de novos ligantes baseados em AAZTA e seus complexos Gd (III) como agentes de contraste para imagens de RM. Universidade de Würzburg, 2012
Citotoxicidade
… meio de contraste contendo gadolínio em células tubulares renais in vitro: Comparação de um meio de contraste de raio-X não iônico contendo iodo com meio de contraste contendo gadolínio nas mesmas concentrações molares e concentrações com a mesma densidade de raio-X. Universidade de Erlangen-Nuremberg, 2011
Dissertações
Arquivo de Notícias
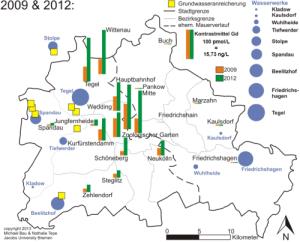
Gadolínio na água potável de Berlim: aumento da poluição em Berlim Ocidental entre 2009 e 2012.
Quanto maior a exposição ao meio de contraste gadolínio, que é inofensivo para a saúde, maior a probabilidade de que outras substâncias veiculadas por águas residuais, como resíduos de drogas e produtos de higiene pessoal, tenham entrado na água potável.
[Karte: Michael Bau und Nathalie Tepe, Jacobs Universität Bremen].

Comprovada a absorção do agente de contraste em plantas: Os pesquisadores despejaram agrião com água contendo agente de contraste por vários dias e então detectaram as substâncias nas folhas.
Imagem: Amostragem no Canal Teltow de Berlim. O agente de contraste gadolínio pode entrar na cadeia alimentar pela água de esgoto.
[Bildquelle: BAM]
Categoria: elementos químicos
Atualizado em 02/02/2020.
Link permanente: https://www.internetchemie.info/chemische-elemente/gadolinium.php
[ad_2]
Source link
